Στη χημεία και τη φυσική, το άτομο είναι το μικρότερο σωματίδιο ενός χημικού στοιχείου
το οποίο διατηρεί τις χημικές ιδιότητες του στοιχείου με την έννοια ότι παραμένει αμετάβ-λητο κατά την εξέλιξη ενός χημικού φαινομένου (χημική αντίδραση). Η λέξη άτομο αρχικά
εννοούσε το μικρότερο δυνατό άτμητο σωματίδιο, αλλά στη συνέχεια ο όρος αυτός απέκτη-
σε ειδικό νόημα στην επιστήμη όταν βρέθηκε πως και τα άτομα αποτελούνται από μικρότε-
ρα υποατομικά σωματίδια.
Όλα τα άτομα, εκτός του "πρώτιου" που είναι ισότοπο του χημικού στοιχείου "υδρογόνο"
και δεν έχει νετρόνια, αποτελούνται από τρεις τύπους υποατομικών σωματιδίων τα οποία
διέπουν τις ιδιότητες των πρώτων :
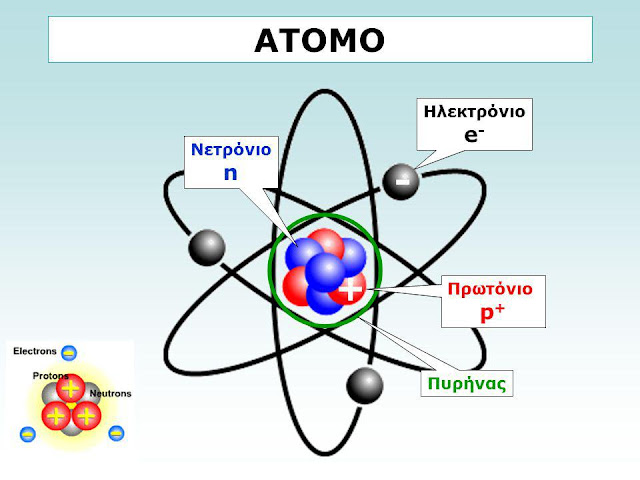
ηλεκτρόνια (e), τα οποία έχουν αρνητικό φορτίο και έχουν τη μικρότερη μάζα.
πρωτόνια (p), τα οποία έχουν θετικό φορτίο και έχουν μάζα περίπου 1836 φορές μεγαλύ-
τερη από αυτή των ηλεκτρονίων και νετρόνια (n), τα οποία δε φέρουν φορτίο και έχουν
μάζα περίπου 1838 φορές μεγαλύτερη από αυτή των ηλεκτρονίων.
Τα πρωτόνια και τα νετρόνια ονομάζονται νουκλεόνια και σχηματίζουν τον συμπαγή
ατομικό πυρήνα. Τα ηλεκτρόνια σχηματίζουν ηλεκτρονικό νέφος το οποίο περιβάλλει τον
πυρήνα.
Ο πυρήνας του ατόμου είναι τόσο μικρός ώστε αν τον μεγεθύναμε ένα τρισεκα-
τομμύριο φορές θα είχε το μέγεθος του κεφαλιού μιας καρφίτσας. Σ’ αυτή τη
μεγέθυνση τα ηλεκτρόνια θα περιφέρονταν γύρω από τον πυρήνα σε απόσταση
μερικών μέτρων, που σημαίνει ότι το άτομο σαν σύνολο θα είχε το μέγεθος ενός
αρκετά μεγάλου δωματίου.
Τα άτομα των διαφόρων χημικών στοιχείων διαφέρουν στον αριθμό των υποατομικών σω-
ματιδίων που περιέχουν. Έτσι για παράδειγμα, ενώ το άτομο του κοινού οξυγόνου αποτε-
λείται από οκτώ πρωτόνια, οκτώ νετρόνια και οκτώ ηλεκτρόνια, το άτομο του κοινού άνθ-
ρακα αποτελείται από 6 πρωτόνια, 6 νετρόνια και 6 ηλεκτρόνια. Ο αριθμός των πρωτονίων
σε ένα άτομο καλείται ατομικός αριθμός και καθορίζει το στοιχείο του ατόμου, είναι
δηλ. κατά κάποιο τρόπο η ταυτότητά του.
Για ένα συγκεκριμένο στοιχείο, ο αριθμός των νετρονίων δεν είναι μοναδικός ενώ ο αριθ-
μός τους καθορίζει το ισότοπο του συγκεκριμένου στοιχείου. Έτσι για παράδειγμα, υπάρ-
χουν στη φύση και σε διάφορα ποσοστά, δύο είδη ατόμων άνθρακα: το ένα περιέχει στον
πυρήνα του 6 νετρόνια ενώ το άλλο 7 νετρόνια. Και τα δύο όμως είδη ατόμων έχουν 6 πρω-
τόνια.
Τα άτομα είναι ηλεκτρικά ουδέτερα αν έχουν ίσο αριθμό πρωτονίων και ηλεκτ-ρονίων. Τα ηλεκτρόνια έχουν τη δυνατότητα κατά την εξέλιξη των διαφόρων χημικών φαινομένων, να μεταφερθούν σε άλλα γειτονικά άτομα ή ακόμη και να μοιρασθούν μετα-
ξύ τους. Άτομα τα οποία έχουν έλλειμμα ή περίσσεια ηλεκτρονίων ονομάζονται
ιόντα.
Ο αριθμός των πρωτονίων και νετρονίων στον ατομικό πυρήνα μπορεί επίσης να αλλάζει,
μέσω της πυρηνικής σύντηξης ή της πυρηνικής σχάσης.
Τα άτομα ενός χημικού στοιχείου έχουν τη δυνατότητα να δημιουργούν χημικούς δεσμούς
με όμοια άτομα ή με άτομα άλλων χημικών στοιχείων. Στην πρώτη περίπτωση σχηματίζεται
μόριο του χημικού στοιχείου, ενώ στη δεύτερη περίπτωση δημιουργείται μόριο χημικής
ένωσης. Για παράδειγμα, δύο άτομα οξυγόνου συνδεδεμένα μεταξύ τους σχηματίζουν ένα
μόριο οξυγόνου, ενώ ένα μόριο νερού είναι συνδυασμός δύο ατόμων υδρογόνου και ενός
ατόμου οξυγόνου.
Πηγές πληροφοριών : Βικιπαίδεια - physics4u - chemist.gr
το οποίο διατηρεί τις χημικές ιδιότητες του στοιχείου με την έννοια ότι παραμένει αμετάβ-λητο κατά την εξέλιξη ενός χημικού φαινομένου (χημική αντίδραση). Η λέξη άτομο αρχικά
εννοούσε το μικρότερο δυνατό άτμητο σωματίδιο, αλλά στη συνέχεια ο όρος αυτός απέκτη-
σε ειδικό νόημα στην επιστήμη όταν βρέθηκε πως και τα άτομα αποτελούνται από μικρότε-
ρα υποατομικά σωματίδια.
Όλα τα άτομα, εκτός του "πρώτιου" που είναι ισότοπο του χημικού στοιχείου "υδρογόνο"
και δεν έχει νετρόνια, αποτελούνται από τρεις τύπους υποατομικών σωματιδίων τα οποία
διέπουν τις ιδιότητες των πρώτων :
ηλεκτρόνια (e), τα οποία έχουν αρνητικό φορτίο και έχουν τη μικρότερη μάζα.
πρωτόνια (p), τα οποία έχουν θετικό φορτίο και έχουν μάζα περίπου 1836 φορές μεγαλύ-
τερη από αυτή των ηλεκτρονίων και νετρόνια (n), τα οποία δε φέρουν φορτίο και έχουν
μάζα περίπου 1838 φορές μεγαλύτερη από αυτή των ηλεκτρονίων.
Τα πρωτόνια και τα νετρόνια ονομάζονται νουκλεόνια και σχηματίζουν τον συμπαγή
ατομικό πυρήνα. Τα ηλεκτρόνια σχηματίζουν ηλεκτρονικό νέφος το οποίο περιβάλλει τον
πυρήνα.
Ο πυρήνας του ατόμου είναι τόσο μικρός ώστε αν τον μεγεθύναμε ένα τρισεκα-
τομμύριο φορές θα είχε το μέγεθος του κεφαλιού μιας καρφίτσας. Σ’ αυτή τη
μεγέθυνση τα ηλεκτρόνια θα περιφέρονταν γύρω από τον πυρήνα σε απόσταση
μερικών μέτρων, που σημαίνει ότι το άτομο σαν σύνολο θα είχε το μέγεθος ενός
αρκετά μεγάλου δωματίου.
Τα άτομα των διαφόρων χημικών στοιχείων διαφέρουν στον αριθμό των υποατομικών σω-
ματιδίων που περιέχουν. Έτσι για παράδειγμα, ενώ το άτομο του κοινού οξυγόνου αποτε-
λείται από οκτώ πρωτόνια, οκτώ νετρόνια και οκτώ ηλεκτρόνια, το άτομο του κοινού άνθ-
ρακα αποτελείται από 6 πρωτόνια, 6 νετρόνια και 6 ηλεκτρόνια. Ο αριθμός των πρωτονίων
σε ένα άτομο καλείται ατομικός αριθμός και καθορίζει το στοιχείο του ατόμου, είναι
δηλ. κατά κάποιο τρόπο η ταυτότητά του.
Για ένα συγκεκριμένο στοιχείο, ο αριθμός των νετρονίων δεν είναι μοναδικός ενώ ο αριθ-
μός τους καθορίζει το ισότοπο του συγκεκριμένου στοιχείου. Έτσι για παράδειγμα, υπάρ-
χουν στη φύση και σε διάφορα ποσοστά, δύο είδη ατόμων άνθρακα: το ένα περιέχει στον
πυρήνα του 6 νετρόνια ενώ το άλλο 7 νετρόνια. Και τα δύο όμως είδη ατόμων έχουν 6 πρω-
τόνια.
Τα άτομα είναι ηλεκτρικά ουδέτερα αν έχουν ίσο αριθμό πρωτονίων και ηλεκτ-ρονίων. Τα ηλεκτρόνια έχουν τη δυνατότητα κατά την εξέλιξη των διαφόρων χημικών φαινομένων, να μεταφερθούν σε άλλα γειτονικά άτομα ή ακόμη και να μοιρασθούν μετα-
ξύ τους. Άτομα τα οποία έχουν έλλειμμα ή περίσσεια ηλεκτρονίων ονομάζονται
ιόντα.
Ο αριθμός των πρωτονίων και νετρονίων στον ατομικό πυρήνα μπορεί επίσης να αλλάζει,
μέσω της πυρηνικής σύντηξης ή της πυρηνικής σχάσης.
Τα άτομα ενός χημικού στοιχείου έχουν τη δυνατότητα να δημιουργούν χημικούς δεσμούς
με όμοια άτομα ή με άτομα άλλων χημικών στοιχείων. Στην πρώτη περίπτωση σχηματίζεται
μόριο του χημικού στοιχείου, ενώ στη δεύτερη περίπτωση δημιουργείται μόριο χημικής
ένωσης. Για παράδειγμα, δύο άτομα οξυγόνου συνδεδεμένα μεταξύ τους σχηματίζουν ένα
μόριο οξυγόνου, ενώ ένα μόριο νερού είναι συνδυασμός δύο ατόμων υδρογόνου και ενός
ατόμου οξυγόνου.
Πηγές πληροφοριών : Βικιπαίδεια - physics4u - chemist.gr
Πολύ καλό το άρθρο σας κύριε Λεοντιάδη και κατανοητό για αδαείς. (Γιάννης από Θεσσαλονίκη) (φυσικός)
ΑπάντησηΔιαγραφήΜπορώ να πω πως κατάλαβα τα περισσότερα, αν και όχι όλα. Πάντως με βοηθήσατε να πάρω μια γενική ιδέα για τη σύσταση του ατόμου. (Γιωργία από Λευκάδα)
ΑπάντησηΔιαγραφή